La Comisión Federal para la Protección Contra Riesgos Sanitarios (Cofepris) aprobó un tratamiento inyectable contra el Covid-19.
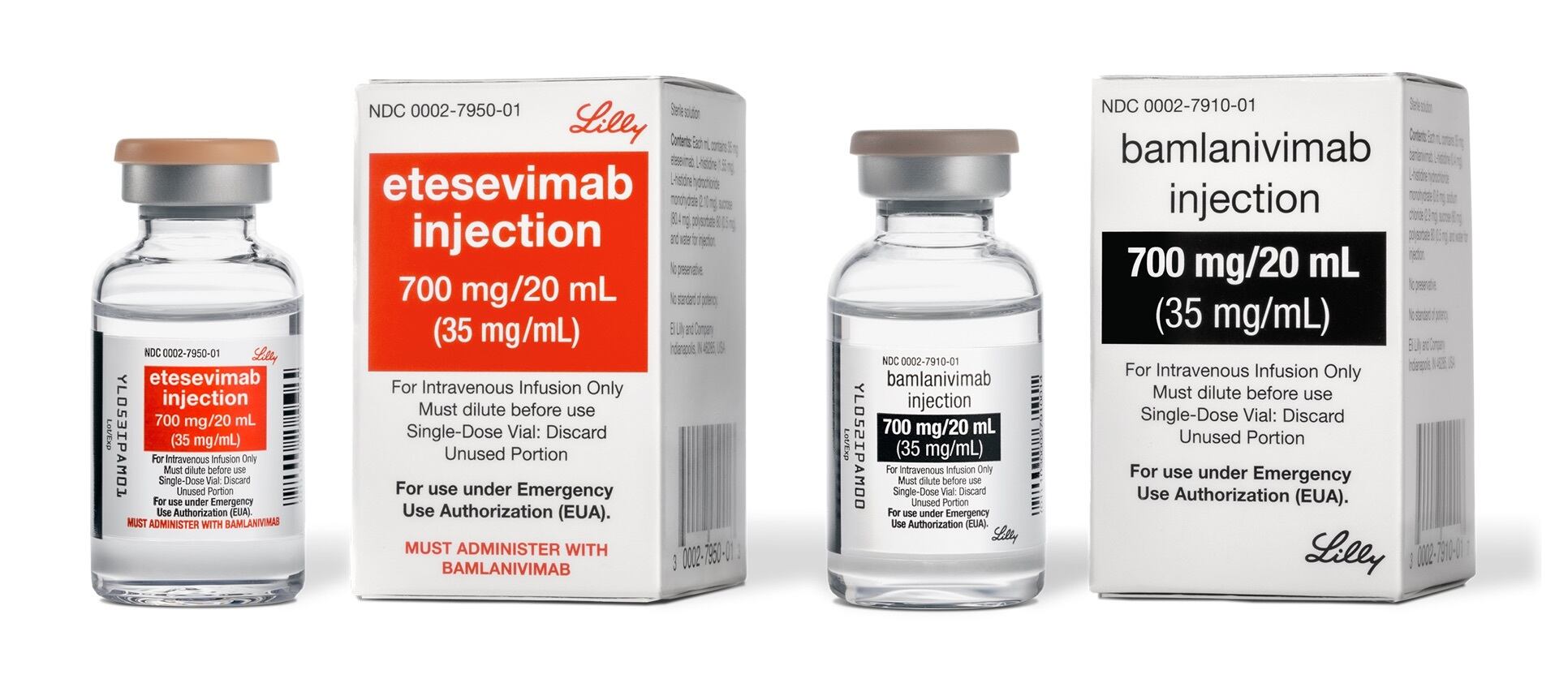
A través de un comunicado, la Cofepris detalló que se trata de una autorización de uso de emergencia de los fármacos biológicos conocidos como bamlanivimab y etesevimab.
Esta combinación de fármacos biológicos en solución inyectable podrá ser utilizada en acciones de atención para pacientes con Covid-19.
“Cofepris emite autorización para uso de emergencia de combinación inyectable para tratar covid-19. Los fármacos bamlanivimab y etesevimab podrán ser utilizados en pacientes adultos y pediátricos siguiendo la indicación terapéutica”
Cofepris en Twitter
¿Quiénes podrán acceder al tratamiento inyectable contra Covid-19?
Este tratamiento inyectable es para las personas que enfermen de manera leve y moderada de Covid-19.
La autorización de la Cofepris es para tratar a personas mayores de 12 años de edad, pesen más de 40 kilogramos y presenten alguna comorbilidad, tales como:
- Obesidad
- Enfermedad renal crónica
- Enfermedad cardiovascular / hipertensión
- Enfermedad pulmonar crónica
- El embarazo
- Enfermedad inmunosupresora / tratamiento inmunosupresor
- Diabetes
La Cofepris aclaró que este tratamiento no sustituye a la vacunación contra el Covid-19.
¿Cuáles son los efectos secundarios del tratamiento inyectable aprobado por Cofepris?
Los efectos secundarios del tratamiento inyectable aprobado por Cofepris que los pacientes podrían presentar por el uso de los fármacos bamlanivimab y etesevimab son:
- Fiebre
- Escalofríos
- Náuseas
- Dolor de cabeza
- Dificultad para respirar
- Presión arterial alta o baja
- Frecuencia cardíaca rápida o lenta
- Malestar o dolor en el pecho
- Debilidad
- Confusión
- Sensación de cansancio
- Sibilancias
- Hinchazón de labios, cara o garganta
- Picazón
- Dolores musculares
- Mareos
- Sudoración
Eli Lilly and Company: La farmacéutica detrás del tratamiento inyectable
La solicitud de autorización fue presentada por la farmacéutica Eli Lilly and Company, fundada en 1876, con sede en Indiana, Estados Unidos.



Los expertos que conforman el Comité de Moléculas Nuevas (CMN) sostuvieron una sesión extraordinaria donde emitieron una opinión favorable unánime del fármaco inyectable contra el Covid-19.
Pese a la aprobación, el CMN continuará con la revisión del expediente presentado por Eli Lilly and Company, y una vez que se decrete la terminación de la emergencia sanitaria se procederá a emitir la correspondiente resolución de conformidad con evidencia y disposiciones legales aplicables.
Los fármacos bamlanivimab y etesevimab como tratamiento contra el Covid-19 han sido aprobados también por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por sus siglas en inglés).



